石墨烯量子点制备及生物应用技术研究进展
杨思维,丁古巧
石墨烯材料与应用联合实验室
中国科学院上海微系统与信息技术研究所
上海烯望材料科技有限公司
摘要:石墨烯量子点是一种重要的石墨烯衍生物,也是横向尺寸最小的石墨烯衍生物。石墨烯量子点以其独特的半导体性质、光学特性、生物安全性在生物医药、新能源、防伪涂层、光探测等领域得到了极大的关注。本文回顾了近年来石墨烯量子点制备技术及其在生物荧光成像、生物荧光检测与诊断、可视化智能治疗等生物应用技术方面的研究进展,同时对石墨烯量子点发展中存在的挑战进行了简要的总结。
1. 前言
作为一种新兴的功能材料,石墨烯量子点以其优异的理化特性、低细胞毒性和出色的水分散性正逐渐取代已应用使用多年的半导体量子点(例如CdSe,CdTe和CdS等)并成为快速发展的热点研究领域之一[1]。在过去的十余年中,石墨烯量子点的研究热点不断发生变化,主要的研究热点包括合成方法创新、石墨烯量子点结构调制、石墨烯量子点发射波长的调制和量子产率提升。目前,石墨烯量子点制备技术方面已开发了主要涵盖自下而上和自上而下方法的多种合成方法。石墨烯量子点结构调制方面,在过去的几年已初步实现了边缘结构调制、晶格掺杂和表面官能团的调节[1]。此外,当前石墨烯量子点的荧光发射波长已实现从深紫外到近红外(250-800 nm)的可控调制。且石墨烯量子点的量子产率也得到了显著的提升,可在一定程度上满足各种应用的需求[2]。这一系列的研究进展使得石墨烯量子点在生物医药、光电催化,光电转换,新能源等领域展现出重要的应用价值(图1)。此篇研究进展回顾了近年来石墨烯量子点的制备技术及其在生物荧光成像、生物荧光检测与诊断、可视化智能治疗等生物应用技术方面的研究进展,同时对石墨烯量子点发展中存在的挑战进行了简要的总结。
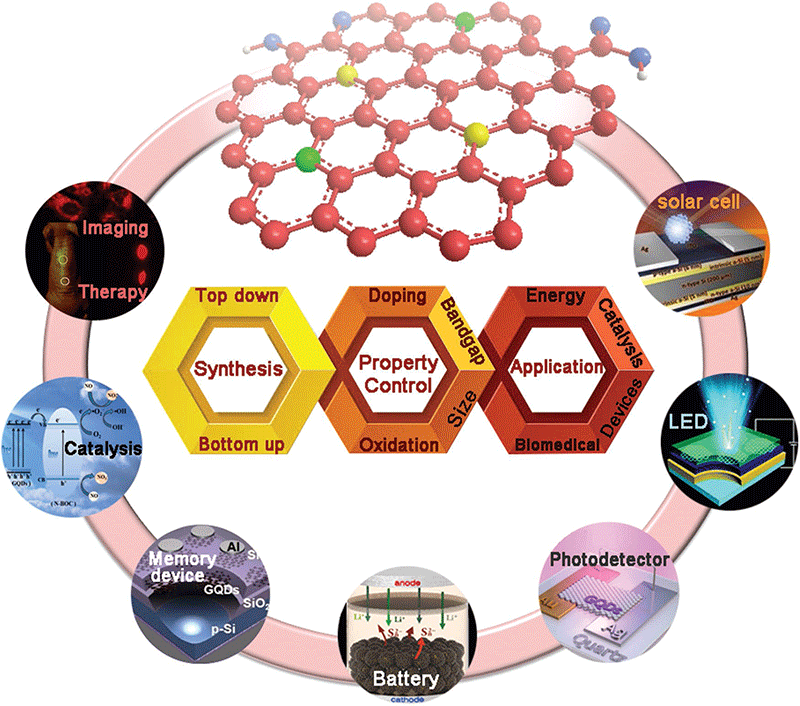
图1. 石墨烯量子点的制备及应用研究进展[1]
2. 石墨烯量子点的定义与相关性质
石墨烯量子点是一种极小尺寸的零维石墨烯碎片(图2)。石墨烯量子点内核由蜂窝状sp2碳结构所构成,其边缘通常由含氧官能团(如羟基、羧基、羰基、环氧基等)所饱和[2]。石墨烯量子点所具有的典型sp2晶格结构是其与碳点区分的重要指标之一(碳点通常由sp2/sp3杂化的较高碳化程度内核与较低碳化程度的外壳所构成,图2)。在量子尺寸效应的作用下,石墨烯量子点的基本物性(如带隙,能带位置和态密度)在很大程度上由量子力学效应所决定[3]。随着尺寸的减小,石墨烯量子点的态密度由连续能级转变为离散能级。进而当石墨烯量子点的尺寸减小到分子或原子尺寸,激子(电子-空穴对)被进一步限制,其能带结构将进一步变得与分子电子结构相同。
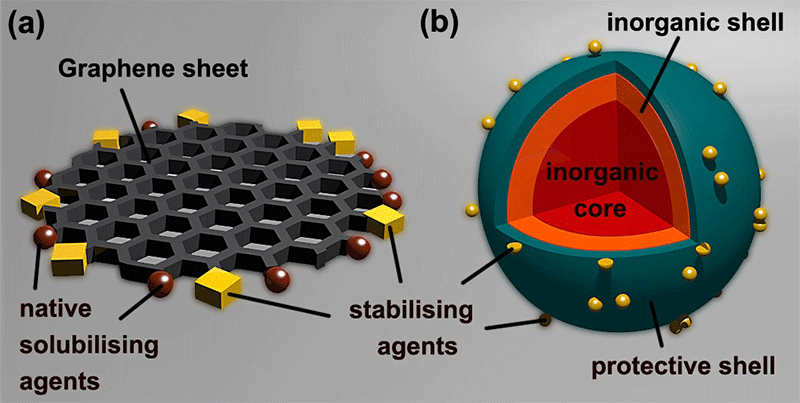
图2. 石墨烯量子点与碳点的结构对比[4]
上述过程的发生使得石墨烯量子点具有一系列独特的性质,然而,对于石墨烯量子点出现量子尺寸效应的典型尺寸的定义目前仍存在很大分歧。表1列举了不同文献对石墨烯量子点典型尺寸的定义。由表可知,对石墨烯量子点典型厚度存在单层、1-2层、小于10层甚至1-10层以上等一系列大小不一的定义。另一方面,其典型横向尺寸也存在从小于10 nm到小于100 nm不等的定义。目前,大多文献报道中的石墨烯量子点典型的厚度小于10层,其典型的横向尺寸小于10 nm。
表1.石墨烯量子点尺寸的不同定义(NA: 未提及)
3. 石墨烯量子点的制备
石墨烯量子点的制备是其基本物性研究及应用研究的基石。目前,石墨烯量子点的制备技术主要可归类为以大尺寸碳材料前驱体的剪切为主要思路的自上而下法和以小分子、生物质材料碳化偶联为主要思路的自下而上法两类(图3)[3]。这两类制备技术在显示各自优势的同时也存在着或多或少的缺点。
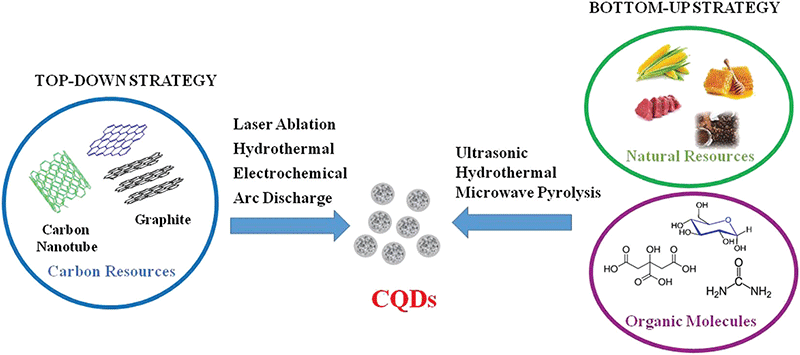
图3. 石墨烯量子点的不同制备思路[3]
3.1.自上而下法
作为获得石墨烯量子点的最直接方法,自上而下法通过廉价易得的碳材料(石墨、碳纳米管、石墨烯等[3])的剪切与氧化实现石墨烯量子点的制备。具体的实施方法包括物理剪切[4]、电化学剪切[3]和化学氧化剪切[2]等。Zhou等人以多壁碳纳米管为工作电极,铂丝为对电极,以0.1 mol/L四丁基高氯酸胺的乙腈溶液为电解液制备获得了石墨烯量子点[14]。所获得的石墨烯量子点发光波长位于蓝光波段,量子产率为6.4%;Li等人以石墨为电极,氢氧化钠/乙醇为电解质制备了不同尺寸的石墨烯量子点[15]。电化学法制备得到的石墨烯量子点通常具有良好的分散性、高结晶度,且易于纯化。
相比电化学氧化剪切,化学氧化法在石墨烯量子点制备方面应用更为广泛。目前主要的化学氧化反应体系借助混酸、自由基、溶剂热环境等实现(图4)[8]。其中混酸氧化法是最常用的化学氧化方案。虽然化学氧化法被广泛应用于石墨烯量子点的制备,同时该方案制备获得的石墨烯量子点往往具有较为完整的石墨烯sp2结构,然而该方案存在氧化反应安全性低(特别是混酸氧化方案)、酸性废弃物处理困难、原材料利用率及量子点产率低下、纯化困难等一系列问题,因此化学氧化剪切方案难以满足日益增长的石墨烯量子点规模化制备的需求。
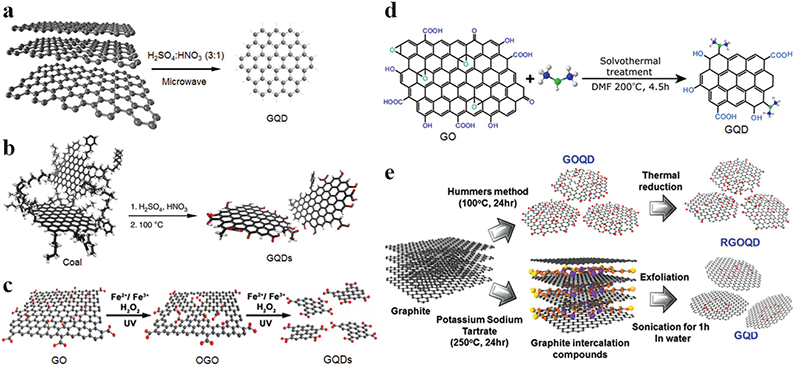
图4.石墨烯量子点制备过程中常见的化学氧化体系[3]
3.2.自下而上法
随着自上而下法的发展,研究人员发现,自上而下法存在所获产物量子产率低、制备效率低且含有大量大尺寸副产物等一系列缺点。在石墨烯量子点sp2蜂窝状结构的启发下,研究者们开始利用小分子之间的碳化偶联来制备石墨烯量子点,该类方法被称为自下而上法。典型的自下而上法包括有机合成[4]、溶剂热合成[8]、电化学合成等[4]。传统的自下而上法通常利用有机小分子(如葡萄糖、蔗糖、乙二胺、尿素、柠檬酸等)实现石墨烯量子点的制备。此外,在绿色化学目标的指引下,大量生物质碳源(如榴莲、鸡蛋、稻草等)也被应用于石墨烯量子点的自下而上法制备中。水热法和微波辅助法是生物质自下而上法制备方案中常用的技术。值得一提的是,Liangshi Li课题组通过精确的有机合成技术实现了一系列具有确定分子结构的石墨烯量子点的制备[16]。该课题组的系列研究工作提供了具有明确结构定义的石墨烯量子点材料,为石墨烯量子点基本物性研究奠定了重要基础(图5)。
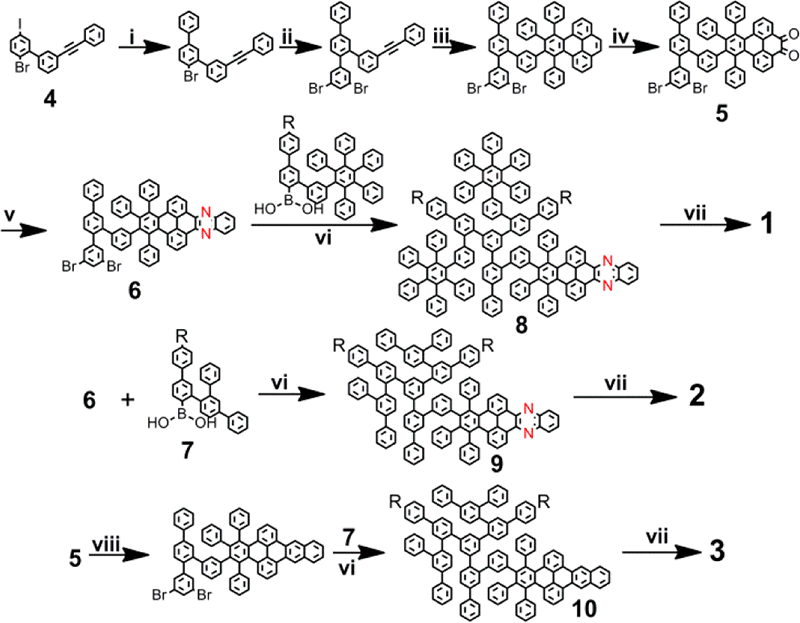
图5. 通过有机合成技术制备石墨烯量子点[16]
利用有机小分子进行石墨烯量子点自下而上法制备方面,熊焕明课题组以尿素和对苯二胺为原料通过水热法制备了多种发光波长的石墨烯量子点[17]。其中红光石墨烯量子点的量子产率为24%。该方法制备的石墨烯量子点具有稳定的荧光性能且展现出高量子产率,最高量子产率达94%。利用生物质碳源进行石墨烯量子点自下而上法制备方面,丁古巧课题组与宁波大学王刚课题组利用铂催化剂对榴莲进行水热处理,实现了晶格S掺杂的石墨烯量子点的制备[18]。该量子点中S原子以噻吩结构存在于sp2晶格中(图6),具有良好的光学和化学稳定性及超高的量子产率。该工作同时研究了水热反应过程的详细机理,明确了生物质碳源在复杂反应条件下量子点的合成机制。

图6. 利用榴莲实现的S掺杂石墨烯量子点自下而上制备[18]
虽然自下而上法解决了自上而下法存在的一些问题,但是其自身也面临着石墨烯量子点碳化过程中的聚集、尺寸调制和产物均一性调制困难、副产物复杂等一系列问题。通常来说,自下而上法制备获得的石墨烯量子点需要再进行如过滤、离心、透析、凝胶电泳和柱色谱的后处理。总之,石墨烯量子点的制备技术在近年来虽得到了长足的发展,但相较于已实现相对成熟规模化制备技术的其他石墨烯衍生物,石墨烯量子点的公斤级以上制备仍存在技术瓶颈,这一现状严重阻碍了石墨烯量子点的应用技术发展。
4. 石墨烯量子点在生物医药领域的应用进展
传统的半导体量子点(如CdSe、CdTe等)由于其可调节的荧光发射波长、高量子产率等一系列优势,在需要稳定的强荧光应用领域使用了很长的时间。然而,传统半导体量子点的高毒性限制了它们在临床条件下的实际应用。相较而言,石墨烯量子点优异的化学惰性、生物相容性以及较低的制备成本使其在生物医药领域展现了显著的优势。目前,石墨烯量子点在生物医药领域的应用主要围绕其典型的荧光性能展开,具体包括生物荧光成像、生物荧光检测与诊断、可视化智能治疗等。
4.1.生物荧光成像
借助石墨烯量子点的荧光特性,实现亚细胞、细胞、组织水平的荧光成像是石墨烯量子点最为重要和研究投入最多的应用领域之一。作为石墨烯量子点最早得到研究的应用场景之一,细胞水平的荧光成像是实现多样化生物荧光成像的基础,同时也为进一步的荧光诊断、可视化智能治疗等技术的发展提供了重要的技术支持。孙静等人通过在石墨烯量子点中引入晶格N原子,实现了石墨烯量子点量子产率的大幅提升,进一步的研究表明,该结构的石墨烯量子点在细胞质中稳定存在,可实现高效的细胞水平荧光成像[19]。
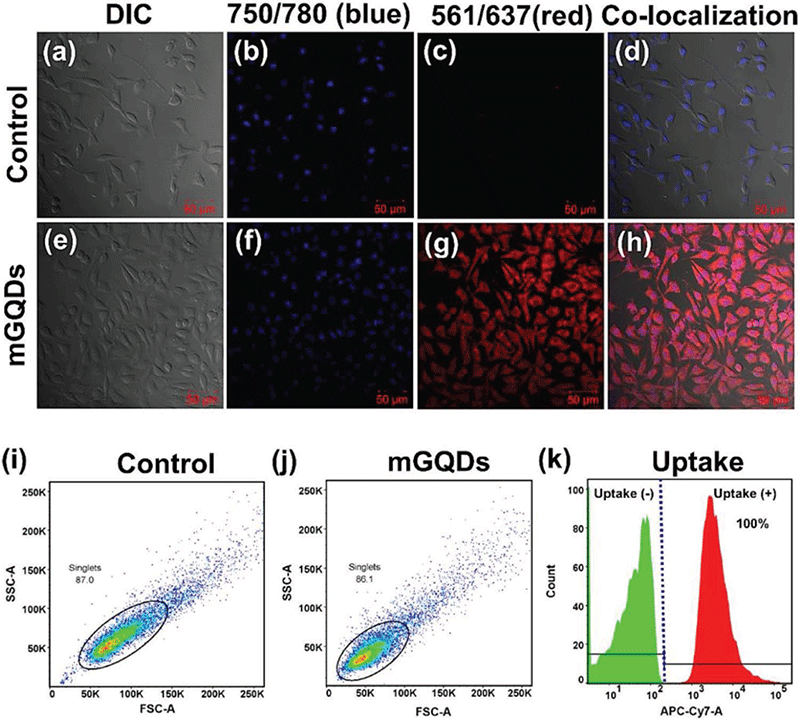
图7. (a–d)未经红光发射石墨烯量子点处理的细胞仅显示DAPI染色的细胞核,在近红外波段无信号。(e-h)被DAPI和红光发射石墨烯量子共标记的细胞其细胞质在近红外波段显示清晰的。(i-k)红光发射石墨烯量子点标记后的细胞在流式细胞分析中的应用,准确率达到100%[20]。
在进一步的研究中,研究者着眼于利用石墨烯量子点实现更大尺度下组织水平的活体荧光成像及更小尺度下亚细胞水平的生物荧光成像。这两类成像技术对临床诊断技术开发、疾病发生机理研究的发展具有重要意义。
组织水平荧光成像方面所面临的主要困难在于实现红光/近红外发光波段石墨烯量子点的获得。众所周知,生物体自身荧光以蓝绿光为主,因此多数蓝绿光发光波段的石墨烯量子点在应用于组织水平的荧光成像时将面临信号难以与生物体自身荧光相区分的问题。与此同时,短波长的蓝绿色荧光低下的组织穿透深度也阻碍了目标组织在活体生物体外的有效荧光成像。为了解决该问题,研究者们针对红光/近红外发光石墨烯量子点的制备开展了大量的工作。Kumawat等人使用微波辅助方法处理芒果叶片的乙醇提取物获得了红色发光的石墨烯量子点[20]。所制备的石墨烯量子点在生物成像中被证明是有效的近红外响应荧光探针,该量子点可选择性地自定位在细胞质中(图7);Jiechao Ge课题组制备了红光/近红外发射的石墨烯量子点,并证明了该量子点在体外荧光成像方面的重要意义[21]。同时,该研究工作为基于石墨烯量子点的高效肿瘤可视化光动力治疗提供了重要的材料学基础。
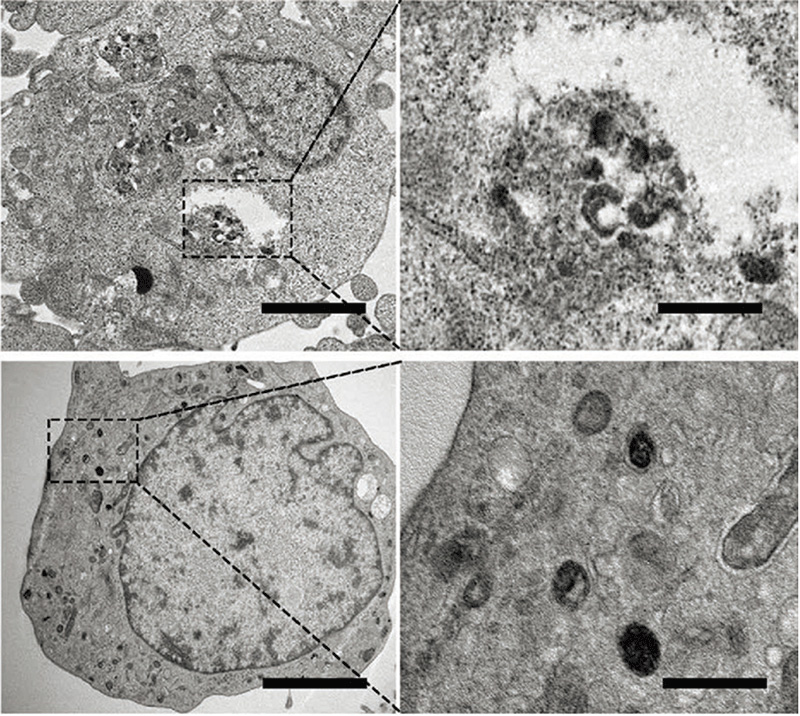
图8. 石墨烯量子点在肿瘤细胞自噬泡中的富集[21]
亚细胞水平荧光成像方面,前期研究工作表明,石墨烯量子点主要通过浓度扩散及内吞过程自由分散于细胞的细胞质中,不具有显著的亚细胞水平选择性。这使得利用石墨烯量子点实现亚细胞水平的原位荧光监控存在困难。因此,实现基于石墨烯量子点的亚细胞水平荧光成像所面临的主要问题在于通过合适的结构设计赋予石墨烯量子点特定的亚细胞水平选择性。上海交大医学院附属第九人民医院范先群课题组与微系统所丁古巧课题组发现晶格内N原子有序掺杂的石墨烯量子点可选择性地富集于肿瘤细胞的自噬泡中(图8),该研究工作不仅明确了肿瘤细胞在摄入石墨烯量子点之后的自我保护机制,同时也促进了肿瘤可视化智能治疗技术的进一步开发[22];张忠平课题组制备了阳离子修饰的石墨烯量子点,该量子点具有追踪细胞核中DNA和RNA的独特能力(图9),该量子点在分别与双链DNA(dsDNA)和单链RNA(ssRNA)结合后可发出光谱上可区分的荧光信号[23]。
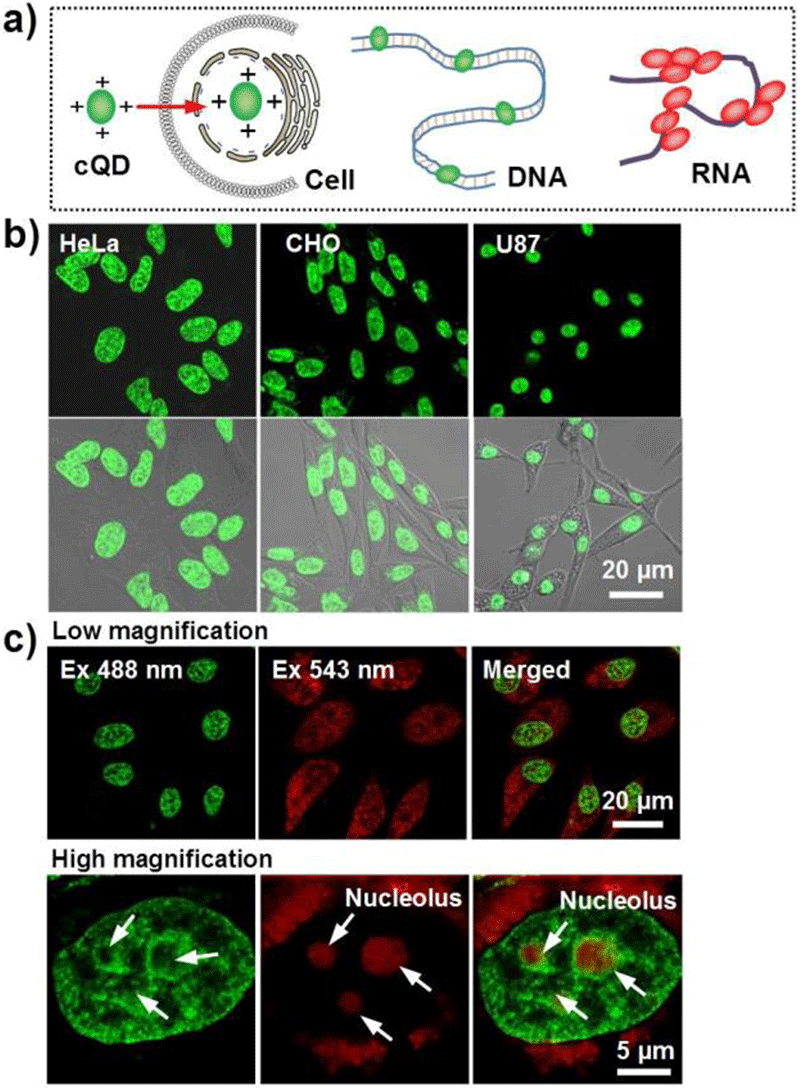
图9.(a)修饰后的石墨烯量子点与细胞核内DNA和RNA相互作用的示意图。dsDNA作用下石墨烯量子点发出绿色荧光,而ssRNA作用下石墨烯量子点发出红色荧光。(b)石墨烯量子点处理的三种细胞系的荧光显微照片。(c)石墨烯量子点处理的HeLa细胞同时被488和543 nm激发后的共聚焦显微照片[23]。
4.2.生物荧光检测与诊断
在实现细胞、亚细胞、组织水平的荧光成像基础上,研究者们借助对石墨烯量子点结构的修饰,逐步实现了大量重要疾病标志物的生物荧光检测,进而开发了多样化的疾病诊断技术。细胞内活性氧化物质(ROS)的评估可极大地加深人们对细胞代谢/增殖过程以及肿瘤发生机制的了解,同时有助于肿瘤诊断技术的开发。丁古巧课题组制备了Se掺杂的石墨烯量子点并成功实现了细胞内ROS代谢过程的原位荧光监控[24]。在此研究工作的基础上,丁古巧课题组在石墨烯量子点中引入环三磷腈结构[25],该结构在细胞内ROS的氧化作用下可使石墨烯量子点的量子产率从12%大幅提升至63%。密度泛函理论计算和实验结果证明环三磷腈环在被氧化后导致了石墨烯量子点电子云的强烈极化进而大幅提升了石墨烯量子点的量子产率。该量子点被进一步应用于细胞内ROS水平的长效评估,准确率为98.3%。进一步的研究表明,该结构的石墨烯量子点对多种肿瘤细胞具有优异的识别性能,肿瘤细胞、体细胞共培养体系下肿瘤细胞的识别率达到90%。血液内循环肿瘤细胞模型中该量子点对肿瘤细胞的识别率达到82.33%(图10);Jingyu Shi等人报道了一种结合石墨烯量子点与金纳米颗粒的新型荧光共振能量转移生物传感器[26]。该传感器能够对金黄色葡萄球菌的特异性基因序列进行定量检测。通过对比加入目标物前后的整个体系的荧光变化,可对目标基因序列进行定量检测,针对金黄色葡萄球菌的检出限为1 nM。
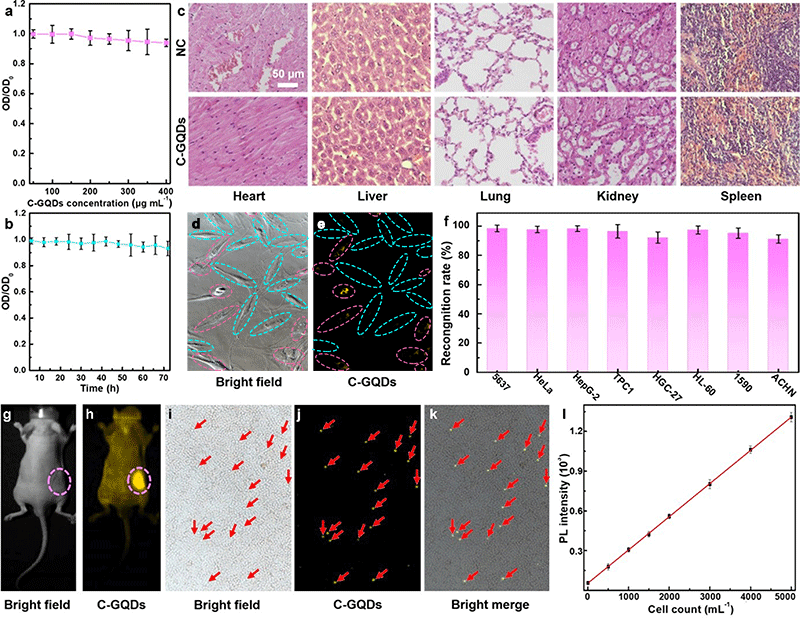
图10. 三聚磷腈环掺杂的石墨烯量子点的生物安全性及其在肿瘤检测领域的应用演示[25]
IsraaAl-Ogaidi等人利用石墨烯量子点开发了一种化学发光免疫芯片,该芯片实现了卵巢癌标志物CA-125的定量检测[27]。IsraaAl-Ogaidi等人首先将石墨烯量子点和CA-125捕获抗体(cAB)依次连接于氨基改性的玻璃片表面,随后利用牛血清白蛋白阻断未反应的活性位点,在待检测物与玻璃片结合后,加入辣根过氧化物酶(HPR)结合的捕获抗体(Ab-HPR)。Ab-HPR能够催化过氧化氢产生活性氧,并与鲁米诺(Luminol)反应产生化学发光。该芯片对CA-125的检出限为0.05 U mL-1(图11)。
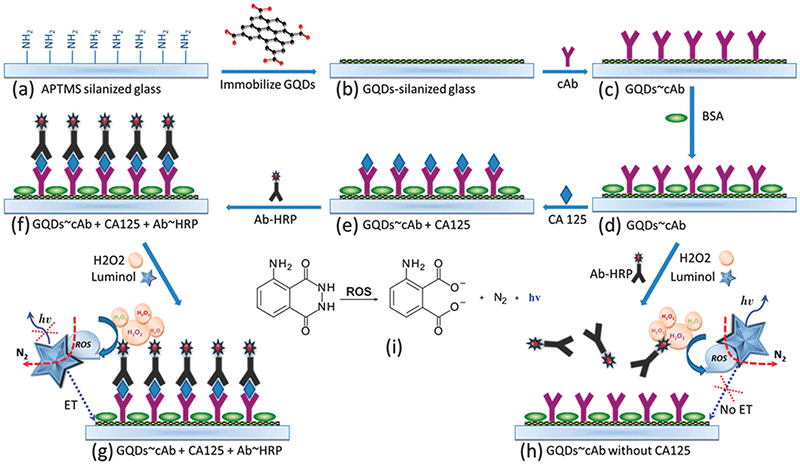
图11. 基于石墨烯量子点的化学发光免疫芯片工作原理示意图[27]
4.3.可视化智能治疗
在实现基于石墨烯量子点的生物成像技术的基础上,研究者们进一步开展了石墨烯量子点在疾病可视化治疗领域的相关探索。其中,针对肿瘤治疗领域的应用探索是该研究领域的热点。Jiechao Ge课题组证明了所制备的红光/近红外发射石墨烯量子点可作为一种新型光动力治疗试剂用于肿瘤光动力治疗中[21]。该石墨烯量子点可通过多态敏化过程产生单线态氧(1O2),1O2量子产率高达1.3,证明了该石墨烯量子点可用于肿瘤的可视化光动力治疗(图12)。
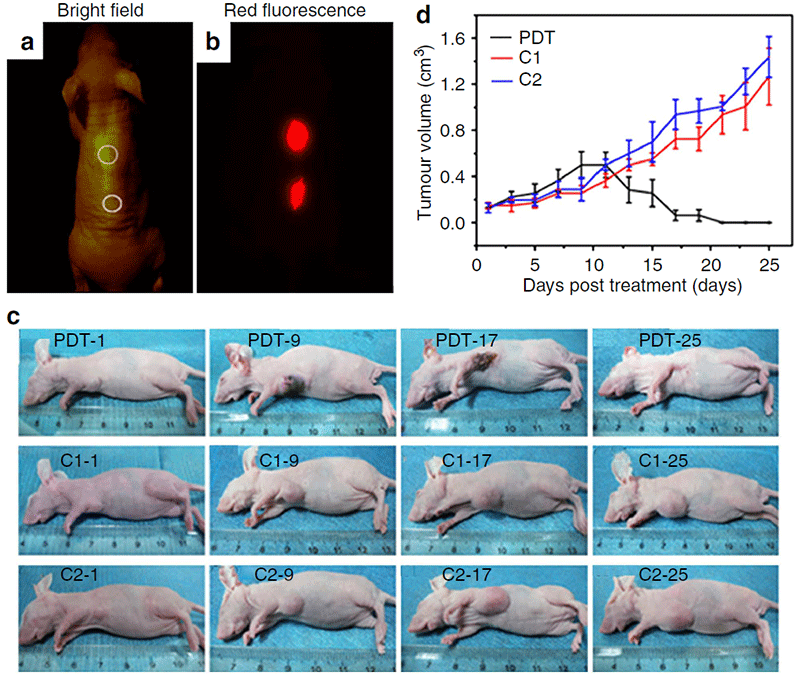
图12.(a)在不同区域皮下注射石墨烯量子点后的明场图像和(b)红色荧光图像。激发波长为502-540 nm,收集的荧光通道为695-775 nm。(c)在第1、9、17和25天进行各种处理后的小鼠照片。(PDT:石墨烯量子点注射并实施光照射;C1:仅注射石墨烯量子点;C2:仅光照射。)(d)不同治疗后随时间下的肿瘤生长曲线[21]。
上海交大医学院附属第九人民医院范先群课题组与微系统所丁古巧课题组在发现肿瘤细胞摄入石墨烯量子点后的自噬保护机制的基础上,进一步提出了基于晶格内N原子有序掺杂石墨烯量子点和自噬抑制药物连用的肿瘤可视化智能治疗方案[28]。细胞、动物活体实验评估结果表明,通过石墨烯量子点和自噬抑制药物联用,可实现肿瘤细胞的靶向高效杀灭。裸鼠皮下肿瘤模型实验结果表明,上述治疗方案在15天中使肿瘤体积显著减小(肿瘤体积缩小75%),相比传统化疗药物其效率提升3-4倍。与此同时,由于高效的靶向能力,治疗过程中毒副作用显著下降。在动物模型中未发现明显全身毒性和器官损伤。该项研究为当前肿瘤治疗技术中遇到的实时监控、高靶向率治疗、抗耐药性三大难点提供了新的思路和有效的解决方案。
在其他疾病的可视化治疗领域,石墨烯量子点同样也展现了超凡的应用前景。Jeremy J. Mao等人证明了石墨烯量子点在干细胞三系分化中的重要作用[29];Han Seok Ko等人证明了石墨烯量子点能够穿透血脑屏障并有效抑制帕金森综合征中的α-共核蛋白形成纤维化聚集体(图13),从而实现神经细胞的保护,阻止了帕金森综合征的发展[30]。
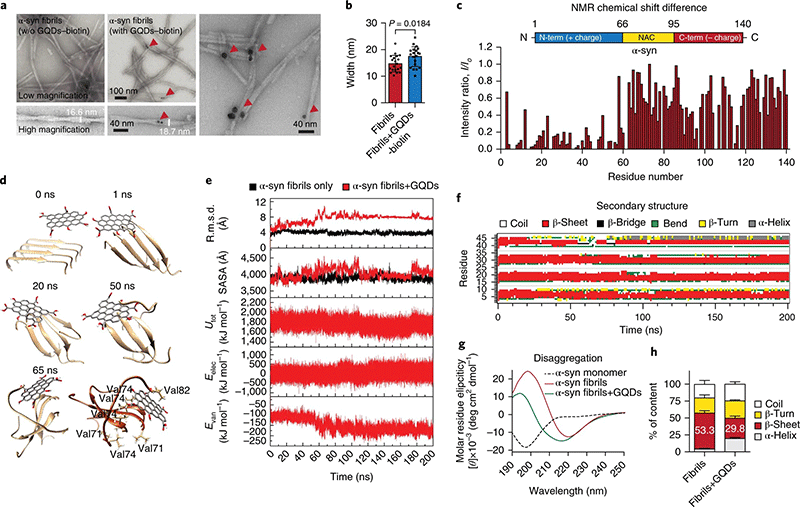
图13.石墨烯量子点与α-共核蛋白的相互作用[30]
5. 挑战与展望
综上所述,本文简要回顾了近年来石墨烯量子点的制备技术及其在生物荧光成像、生物荧光检测与诊断、可视化智能治疗等生物医药领域的研究进展。十余年的发展使石墨烯量子点在诸多领域获得了系列突破,然而该领域的研究仍面临着诸多严峻的挑战。首先,石墨烯量子点的规模化可控制备技术仍有待进一步开发,相较于已实现相对成熟规模化制备技术的其他石墨烯衍生物,石墨烯量子点的公斤级以上制备仍存在技术瓶颈,这一现状严重阻碍了石墨烯量子点的应用技术发展;其次,石墨烯量子点发光机制模型仍存在诸多分歧,这使得石墨烯量子点光学性能的调制仍以“试错法”为主要方法;再次,石墨烯量子点分子生物学层面的生物作用机制仍不明确,Han Seok Ko等人的相关研究工作证明了石墨烯量子点分子生物学层面的生物作用机制研究有助于相关应用技术的进一步开发;最后,具有实际应用市场价值的石墨烯量子点生物医药应用技术仍有待发展。这不仅是石墨烯量子点所面临的重要现实问题,同样也包括石墨烯在内的诸多新型功能材料所面临的共性问题。
参考文献
[1] Yan Y, et al. Recent Advances on Graphene Quantum Dots: From Chemistry and Physics to Applications. Adv. Mater., 2019, 31(21): 1808283.
[2] Lu H T, et al. Graphene Quantum Dots for Optical Bioimaging. Small, 2019, 15(36): 1902136.
[3] Nekoueian K, et al. Carbon-based quantum particles: an electroanalytical and biomedical perspective. Chem. Soc. Rev., 2019, 48(15): 4281-316.
[4] Rakovich A, et al. Semiconductor versus graphene quantum dots as fluorescent probes for cancer diagnosis and therapy applications. J. Mater. Chem. B, 2018, 6(18): 2690-712.
[5] Zhi B, et al. Synthesis, applications and potential photoluminescence mechanism of spectrally tunable carbon dots. Nanoscale, 2019, 11(43): 20411-28.
[6] Li M X, et al. Review of Carbon and Graphene Quantum Dots for Sensing. Acs Sensors, 2019, 4(7): 1732-48.
[7] Zhou X J, et al. Photo-Fenton Reaction of Graphene Oxide: A New Strategy to Prepare Graphene Quantum Dots for DNA Cleavage. ACS Nano, 2012, 6(8): 6592-9.
[8] Sweetman M J, et al. A Practical Guide to Prepare and Synthetically Modify Graphene Quantum Dots. Adv. Funct. Mater., 2019, 29(14): 1808740.
[9] Li L L, et al. Focusing on luminescent graphene quantum dots: current status and future perspectives. Nanoscale, 2013, 5(10): 4015-39.
[10] Haque E, et al. Recent Advances in Graphene Quantum Dots: Synthesis, Properties, and Applications. Small Methods, 2018, 2(10): 1800050.
[11] Zhang Z P, et al. Graphene quantum dots: an emerging material for energy-related applications and beyond. Energy Environ. Sci., 2012, 5(10): 8869-90.
[12]Duran N, et al. Nanobiotechnology of Carbon Dots: A Review. J. Biomed. Nanotechnol., 2016, 12(7): 1323-47.
[13]Chen, et al. Quantum Dots For DNA Biosensing//. Springer Briefs in Molecular Science. Berlin, Germany; Springer. 2013: 102.
[14]Zhou J G, et al. An electrochemical avenue to blue luminescent nanocrystals from multiwalled carbon nanotubes (MWCNTs). J. Am. Chem. Soc., 2007, 129(4): 744-5.
[15]Li X H, et al. Facile ionic-liquid-assisted electrochemical synthesis of size-controlled carbon quantum dots by tuning applied voltages. Rsc Adv, 2014, 4(101): 57615-9.
[16]Li Q Q, et al. Nitrogen-Doped Colloidal Graphene Quantum Dots and Their Size-Dependent Electrocatalytic Activity for the Oxygen Reduction Reaction. J. Am. Chem. Soc., 2012, 134(46): 18932-5.
[17]Ding H, et al. Full-Color Light-Emitting Carbon Dots with a Surface-State-Controlled Luminescence Mechanism. ACS Nano, 2016, 10(1): 484-91.
[18]Wang G, et al. Facile and Highly Effective Synthesis of Controllable Lattice Sulfur-Doped Graphene Quantum Dots via Hydrothermal Treatment of Durian. ACS Appl. Mater. Inter., 2018, 10(6): 5750-9.
[19]Sun J, et al. Ultra-High Quantum Yield of Graphene Quantum Dots: Aromatic-Nitrogen Doping and Photoluminescence Mechanism. Particle & Particle Systems Characterization, 2015, 32(4): 434-40.
[20]Kumawat M K, et al. Graphene Quantum Dots from Mangifera indica: Application in Near Infrared Bioimaging and Intracellular Nanothermometry. Acs Sustain Chem Eng, 2017, 5(2): 1382-91.
[21]Ge J C, et al. A graphene quantum dot photodynamic therapy agent with high singlet oxygen generation. Nat. Commun., 2014, 5: 4596.
[22]Li J P, et al. Emancipating Target-Functionalized Carbon Dots from Autophagy Vesicles for a Novel Visualized Tumor Therapy. Adv. Funct. Mater., 2018, 28(30): 1800881.
[23]Han G M, et al. Membrane-Penetrating Carbon Quantum Dots for Imaging Nucleic Acid Structures in Live Organisms. Angew. Chem., Int. Ed., 2019, 58(21): 7087-91.
[24]Yang S W, et al. Selenium Doped Graphene Quantum Dots as an Ultrasensitive Redox Fluorescent Switch. Chem. Mater., 2015, 27(6): 2004-11.
[25]Xu A L, et al. Polarizing Graphene Quantum Dots toward Long-Acting Intracellular Reactive Oxygen Species Evaluation and Tumor Detection. ACS Appl. Mater. Inter., 2020, 12(9): 10781-90.
[26]Shi J Y, et al. A fluorescence resonance energy transfer (FRET) biosensor based on graphene quantum dots (GQDs) and gold nanoparticles (AuNPs) for the detection of mecA gene sequence of Staphylococcus aureus. Biosens. Bioelectron., 2015, 67: 595-600.
[27]Al-Ogaidi I, et al. Detection of the ovarian cancer biomarker CA-125 using chemiluminescence resonance energy transfer to graphene quantum dots. Chem. Commun., 2014, 50(11): 1344-6.
[28]Li J P, et al. Emancipating Target-Functionalized Carbon Dots from Autophagy Vesicles for a Novel Visualized Tumor Therapy. Adv. Funct. Mater., 2018, 28(30): 1800881.
[29]Shah L S, et al. Labeling of mesenchymal stem cells by bioconjugated quantum dots. Nano Lett., 2007, 7(10): 3071-9.
[30]Donghoon K, et al. Graphene quantum dots prevent α-synucleinopathy in Parkinson’s disease. Nat. Nanotechnol., 2018, 13: 812-18.